Дефицит витамина D

СОДЕРЖАНИЕ
- 1. Краткая информация
- 1.1 Определение
- 1.2 Этиология и патогенез
- 1.3 Эпидемиология
- 1.4 Особенности кодирования по Международной статистической классификации болезней и проблем, связанных со здоровьем
- 1.5 Классификация
- 1.6 Клиническая картина
- 2. Диагностика, медицинские показания и противопоказания к применению методов диагностики
- 2.1 Жалобы и анамнез
- 2.2 Физикальное обследование
- 2.3 Лабораторные диагностические исследования
- 2.4 Инструментальные диагностические исследования
- 2.5 Иные диагностические исследования
- 3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
- 3.1 Медикаментозное лечение
- 3.2 Иное лечение
- 4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
- 5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- 6. Организация оказания медицинской помощи
- 7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
1. КРАТКАЯ ИНФОРМАЦИЯ
1.1 Определение
Дефицит витамина D – это состояние, характеризующееся снижением концентрации 25(ОН)D в сыворотке крови ниже оптимальных значений, которое может потенциально приводить к снижению всасывания кальция в кишечнике, развитию вторичного гиперпаратиреоза и повышению риска переломов, особенно у пожилых лиц.
1.2 Этиология и патогенез
Витамин D, который поступает в организм человека из продуктов питания и в виде пищевых добавок, а также образуется в коже при инсоляции, биологически инертен. Для активации и превращения в активную форму D-гормона [1,25(ОН)2D] в организме он должен пройти два этапа гидроксилирования [1].
В результате первого этапа гидроксилирования, который происходит в печени, нативный витамин D превращается в 25-гидроксивитамин D [25(OH)D], также известный как кальцидиол (Рис.1). Второй этап гидроксилирования происходит преимущественно в почках с участием фермента CYP27B1 (1α-гидроксилазы), и его результатом является синтез физиологически активного D-гормона, 1,25-дигидроксивитамина D [1,25(OH)2D] или кальцитриола. Сывороточный уровень кальцитриола преимущественно зависит от активности CYP27B1 в почках, которая находится под контролем паратиреоидного гормона (ПТГ), а также жёстко регулируется отрицательной обратной связью. Последняя замыкается ингибированием CYP27B1 высокими концентрациями самого кальцитриола и фактора роста фибробластов 23 (FGF23). Фермент CYP24A1 (24-гидроксилаза) превращает 25(OH)D и 1,25(OH)2D в не обладающие биологической активностью метаболиты, выводимые из организма с желчью. Процесс 24-гидроксилирования регулируется реципрокно 1α-гидроксилированию. Описаны также другие, второстепенные метаболические пути витамина D. Например, под действием 3-эпимеразы образуются метаболиты, обладающие частичной биологической активностью. Основные этапы метаболизма витамина D указаны на рисунке 1.
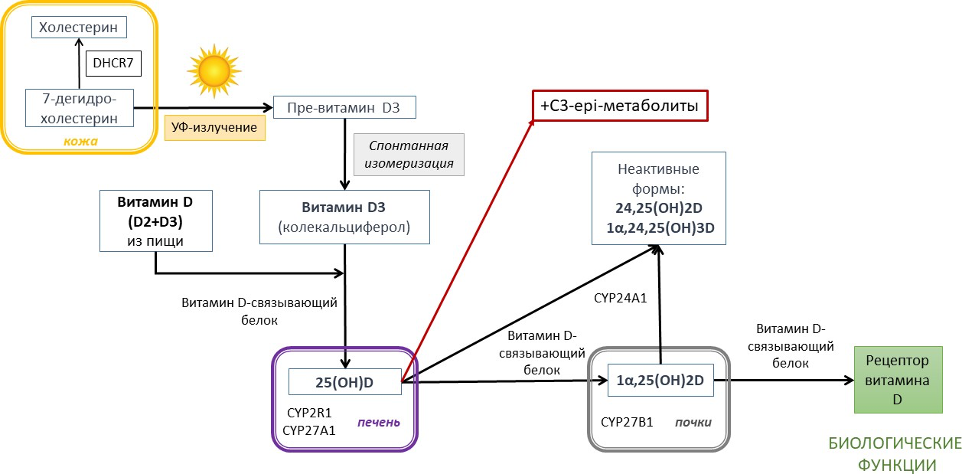
Рисунок 1. Метаболизм витамина D в организме человека.
Витамин D естественным образом присутствует лишь в очень ограниченном количестве продуктов питания (Таб. 1), а синтез в организме человека возможен только в определенных условиях, когда ультрафиолетовые (УФ) лучи солнечного света попадают на кожу.
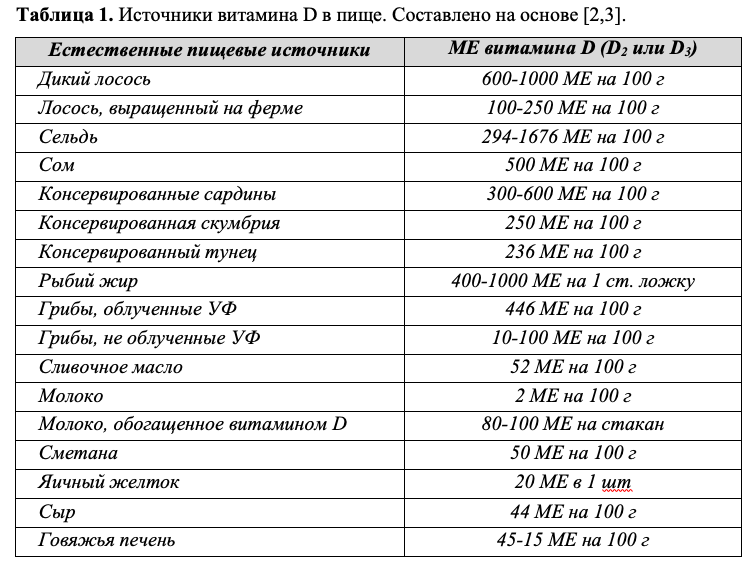
Низкое содержание витамина D в большинстве продуктов питания само по себе представляет риск дефицита, развитие которого становится еще более вероятным при аллергии на молочный белок, непереносимости лактозы, ововегетарианстве и строгом вегетарианстве. Таким образом, основным источником витамина D становится образование его под действием УФ лучей, однако, имеющиеся на сегодняшний день рекомендации по уменьшению времени пребывания на солнце и применению солнцезащитных кремов, снижающих синтез витамина D в коже на 95-98% [4], существенно снижают его эффективность. Способность кожи к продукции витамина D уменьшается с возрастом, и у пожилых лиц ниже по крайней мере в 3 раза в сравнении с молодыми людьми [5]. Люди с темным тоном кожи имеют естественную защиту от ультрафиолетового излучения, и им требуется как минимум в 3-5 раз более длительная экспозиция солнечного излучения, чтобы выработать такое же количество витамина D, как человеку со светлой кожей [6]. Рахит больше распространен среди выходцев из Азии, Африки и Ближнего Востока, что может быть обусловлено культурными особенностями, которые уменьшают воздействие солнечных лучей на кожу, а также генетическими различиями в метаболизме витамина D [7,8].
Вклад в развитие дефицита витамина D в нашей стране может вносить географическое расположение большей части Российской Федерации в северной широте выше 35 параллели, при котором из-за более острого угла падения солнечных лучей и их рассеивания в атмосфере в период с ноября по март кожа практически не вырабатывает витамин D, вне зависимости от времени, которое проводится человеком на солнце [9,10]. Например, Москва имеет координаты 55°45′, Санкт-Петербург - 59°57, Сочи - 43°35′, Владивосток - 43°07′ северной широты. Также свой вклад вносят сравнительно небольшое количество солнечных дней в большинстве регионов страны и средняя годовая температура, не позволяющая обеспечить облучение достаточной поверхности кожи для синтеза необходимого количества витамина D.
Увеличение числа лиц с избыточной массой тела приводит к повышению распространенности дефицита витамина D [11], что связывают с депонированием витамина D в подкожно-жировой клетчатке и его недоступностью для центрального кровотока [12].
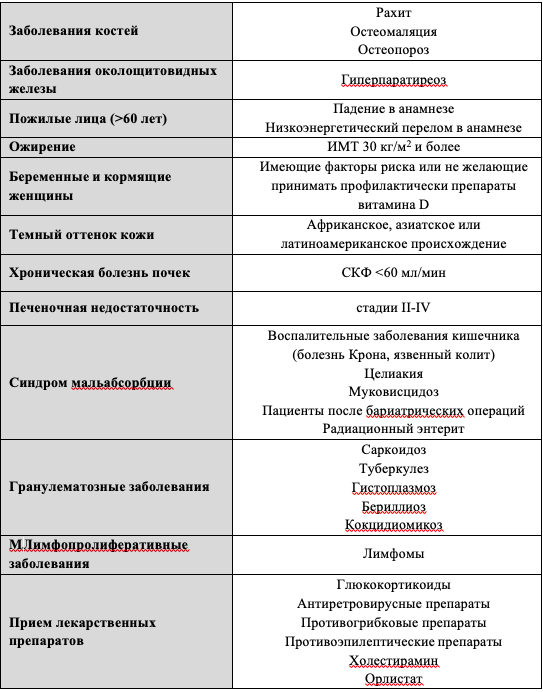
Другими причинами дефицита витамина D являются нарушение его усваивания с пищей при различных синдромах мальабсорбции [13–15], в том числе у пациентов после бариатрических операций [16,17], а также потеря витамина D с мочой в комплексе со связывающим его белком при нефротическом синдроме [18]. При выраженной печеночной недостаточности развитие дефицита витамина D может происходить по ряду причин: снижаются уровни транспортных белков сыворотки, нарушается 25- гидроксилирование витамина D в печени и ускоряется его катаболизм, кроме того, часто усугубляет ситуацию неполноценное питание и малое пребывание на солнце [19]. При хронических гранулематозных заболеваниях, первичном гиперпаратиреозе, некоторых видах лимфом может наблюдаться повышенное превращение 25(ОН)D в 1,25(ОН)2D, что приводит к повышенному расходу запасов витамина D [20,21]. Снижение уровня 25(OH)D может быть ассоциировано с приемом ряда лекарственных препаратов, которые оказывают значимое влияние на метаболизм витамина D в организме [22]. Таким образом, выделены группы риска дефицита витамина D, которые представлены в таблице 2.
Таблица 2. Группы лиц с высоким риском тяжелого дефицита витамина D, которым показан биохимический скрининг.
1.3 Эпидемиология
Недостаточность витамина D, как определяемая уровнями 25(OH)D менее 30 нг/мл, так и менее 20 нг/мл, имеет широкое распространение во всем мире и затрагивает большую часть общей популяции. Однако, обобщенный анализ проведенных эпидемиологических исследований затруднен в силу недостаточного внедрения в исследовательскую практику стандартизированных измерений концентрации 25(OH)D. В исследовании NHANES III (1988–1994) среди более 18000 жителей Северной Америки уровни 25(ОН)D ниже 12, 20 и 30 нг/мл наблюдались у 4%, 22% и 55%, а по результатам переоценки данных с применением протоколов Vitamin D Standardization Program (VDSP)
- доли увеличились до 6%, 31% и 71% соответственно [23]. Полученные данные были подтверждены в NHANES 2000–2004 [24]. В большинстве европейских стран также очень высока распространенность низких уровней 25(ОН)D. Для более достоверной оценки распространенности дефицита витамина D в Европе протоколы VDSP были применены к данным 14 популяционных исследований; полученные результаты были проанализированы совместно с 4 ранее стандартизованными исследованиями: среди 55844 европейских жителей различного возраста уровень 25(ОН)D ниже 12 нг/мл наблюдался у 13% обследованных (при этом отмечались выраженные сезонные отличия – доля составила 18% в период с октября по март и 8% с апреля по ноябрь), уровни ниже 20 нг/мл отмечены у 40% лиц [25].
Результаты проведенных в Российской Федерации исследований согласуются с мировыми данными: уровни 25(ОН)D менее 30 нг/мл выявляются в среднем у 70-95% взрослых лиц [26–34], при этом в ряде исследований показаны сезонные различия [31,32,34]. По результатам первого многоцентрового регистрового исследования, охватившего большую часть территории страны, уровни ниже 20 нг/мл отмечены у 56% обследованных взрослых лиц в весенний период (с марта по май) и у 26% лиц в осенний период (октябрь-ноябрь), а уровни ниже 30 нг/мл – у 84% и 62% соответственно [35–37]. Следует отметить, что беременные и кормящие женщины даже при приеме пренатальных витаминных комплексов и препаратов кальция все равно остаются в зоне риска дефицита витамина D [34,38–40].
1.4 Особенности кодирования по Международной статистической классификации болезней и проблем, связанных со здоровьем
Е21.1 – Вторичный гиперпаратиреоз E55 – Недостаточность витамина D
E55.9 – Недостаточность витамина D неуточненная M83 – Остеомаляция у взрослых
1.5 Классификация
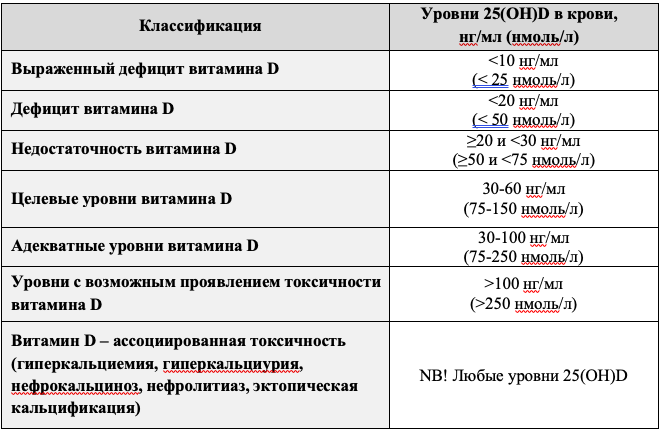
Классификация уровней 25(ОН)D представлена в таблице 3.
Таблица 3. Интерпретация концентраций 25(OH)D, принимаемая Российской ассоциацией эндокринологов.
1.6 Клиническая картина
Дефицит витамина D приводит к нарушению кальций-фосфорного обмена и костного метаболизма. Вследствие снижения всасывания в кишечнике поступающего с пищей кальция увеличивается уровень ПТГ и развивается вторичный гиперпаратиреоз, который поддерживает нормальный уровень кальция сыворотки крови за счет мобилизации его из скелета [41,42]. ПТГ повышает активность остеокластов, и тем самым приводит к снижению минеральной плотности кости (МПК), остеопении и остеопорозу.
Повышение экскреции фосфора с мочой при повышенной продукции ПТГ, а также сниженное всасывание в кишечнике может приводить к снижению его сывороточной концентрации. Изменение кальций-фосфорного соотношения приводит к нарушению процесса минерализации скелета [43]. В связи с тем, что эпифизарные зоны роста у взрослых закрыты, запасы кальция в скелете сравнительно большие для предотвращения деформаций вследствие дефекта минерализации, развитие остеомаляции как правило длительное время не диагностируется. Её проявлениями могут быть изолированные или генерализованные боли, неприятные ощущения в костях и мышцах [44,45].
Дефицит витамина D может приводить к миопатии, которая проявляется мышечной слабостью, особенно в проксимальных группах мышц, трудностями при ходьбе, поддержании равновесия и склонностью к падениям [46,47], что закономерно увеличивает риск переломов. Каких-либо особенных физикальных изменений при дефиците витамина D нет. Могут наблюдаться деформации скелета, характерные для перенесенного рахита в детстве («башенный» череп, дугообразно изогнутые длинные кости нижних конечностей, реберные «четки», деформация грудной клетки и др.).
2. Диагностика, медицинские показания и противопоказания к применению методов диагностики
Критерии установления диагноза:
- концентрация 25(ОН)D в сыворотке крови менее 10 нг/мл (25 нмоль/л) соответствует выраженному дефициту витамина D;
- концентрация 25(ОН)D в сыворотке крови менее 20 нг/мл (50 нмоль/л) соответствует дефициту витамина D;
- концентрация 25(ОН)D в сыворотке крови в диапазоне ≥20 и <30 нг/мл (≥50 и
<75 нмоль/л) соответствует недостаточности витамина D.
2.1 Жалобы и анамнез
- Рекомендуется сбор анамнеза, направленный на выявление факторов риска дефицита витамина D, перечисленных в Таблице
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4). Комментарии: см. раздел «Клиническая картина».
2.2 Физикальное обследование
-
Специфическое физикальное обследование не рекомендуется.
Уровень убедительности рекомендаций C (уровень достоверности доказательств – 4). Комментарии: см. раздел «Клиническая картина».
2.3 Лабораторные диагностические исследования
- Широкий популяционный скрининг дефицита витамина D не рекомендуется. Скрининг на дефицит витамина D рекомендуется только пациентам, имеющим факторы риска его развития (Таб. 2) [3,48,49].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии: Проведение популяционного скрининга, направленного на выявление недостатка витамина D, не рекомендуется ввиду отсутствия доказательной базы по преимуществу такого подхода, а также его высокой стоимости [3,48,49]. Проведение скрининга дефицита витамина D является целесообразным среди лиц с высоким риском его развития (Таб.2).
- Рекомендуется проводить оценку статуса витамина D путем определения концентрации общего 25(ОН)D в сыворотке крови [2,50,51].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 2)
Комментарии: Концентрация общего 25(ОН)D в сыворотке крови является общепризнанным лучшим маркером для оценки статуса витамина D, так как представляет собой основную циркулирующую форму витамина D с временем полужизни порядка 2-3 недель, а также отражает как поступление витамина D с пищей и нативными препаратами витамина D, так и синтезированный в коже под воздействием УФ облучения [2,50]. Вместе с этим, поскольку концентрация общего 25(OH)D не подвержена жесткой физиологической регуляции, в последнее время активно обсуждаются другие потенциальные маркеры, в частности, свободный 25(OH)D (несвязанный с белками-носителями) или соотношение 25(OH)D/24,25(OH)2D [51], однако для внедрения этих показателей в рутинную клиническую практику требуется разработка стандартизированных методов измерения и дополнительные исследования, подтверждающие связь с клиническими исходами.
- Для оценки уровня 25(ОН)D рекомендуется использование метода, стандартизированного в соответствии с требованиями Vitamin D Standartization Program (VDSP) [23,25,52–55].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии: Все клинические анализы, включая измерения концентрации 25(OH)D, подвержены изменчивости. Существует множество методик измерения 25(OH)D, которые можно разделить на две большие группы: основанные на иммуноанализе (радиоиммуноанализ, хемилюминесцентный иммуноанализ, иммуноферментный анализ, электрохемилюминесцентный иммуноанализ) и хроматографические (масс- спектрометрия с жидкостной хроматографией) [52].
Стандартизация - это процесс, при котором все лаборатории и используемые ими методы определения вещества приводятся в соответствие с «истинной концентрацией» на основе референсных измерительных процедур («золотых стандартов») и сертифицированных референсных материалов [53]. Показано, что применение стандартизированных методов может привести к получению радикально иных результатов в индивидуальных исследованиях [25,54]. Недостаточный охват методов определения 25(OH)D стандартизацией является важнейшей проблемой, которая затрудняет разработку критериев интерпретации статуса витамина D на всём диапазоне от дефицита до токсичности [23].
Для решения этой проблемы в 2010 году была создана Программа стандартизации витамина D (Vitamin D Standardization Program, VDSP) – международная коллаборация, целью которой является стандартизация лабораторного определения уровня витамина D [55]. Согласно рекомендациям VDSP, для обеспечения согласованности результатов различных методов определения 25(OH)D производителям тест-систем и крупным коммерческим или клиническим лабораториям следует участвовать в программе сертификации, разработанной Centers for Disease Control and Prevention (CDC), а для менее крупных лабораторий функционируют схемы тестирования производительности и программы внешней оценки качества, такие как DEQAS (Vitamin D External Quality Assessment Scheme), а также разработанная CAP (College of American Pathologists).
- При определении концентрации 25(OH)D в динамике рекомендовано
использование одного и того же метода [56].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Из-за преимуществ автоматизации и быстрого получения результатов иммуноаналитические методы являются наиболее часто используемыми для измерения концентрации 25(ОН)D в клинических лабораториях. Существенным недостатком этих методов является перекрестная реактивность между различными метаболитами (в частности, с 24,25(OH)2D), что способно снизить специфичность анализа. С другой стороны, при использовании хроматографических методов не всегда отделяется 3‐epi‐25‐(OH)D, в результате чего снижается чувствительность метода [56]. В условиях недостаточной доступности стандартизированных методов может быть оправдано использование одного и того же метода для динамической оценки уровня 25(ОН)D.
- Рекомендуется определять дефицит витамина D как концентрация 25(ОН)D <20 нг/мл (50 нмоль/л), недостаточность как концентрация 25(ОН)D ≥20 и <30 нг/мл (≥50 и <75 нмоль/л), адекватные уровни как 30-100 нг/мл (75-250 нмоль/л), целевые уровни как 30-60 нг/мл (75-150 нмоль/л) [2,3,46,51,54,57–71].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1).
Комментарии: Определение дефицита витамина D является предметом дебатов в международном сообществе. Уровни 25(OH)D ниже 12 нг/мл (30 нмоль/л) признаются явно недостаточными для всех возрастов, поскольку ассоциированы с повышением риска рахита и остеомаляции [51]. В отношении трактовки достаточных концентраций 25(ОН)D существуют разногласия: рядом международных сообществ рекомендовано придерживаться уровней выше 20 нг/мл (50 нмоль/л) [2,67,68], тогда как другие эксперты рекомендуют уровни выше 30 нг/мл (75 нмоль/л) [3,51], по крайней мере, для отдельных категорий (например, для пожилых лиц, имеющих повышенный риск переломов и падений [68].
Для оценки нижней точки достаточности уровня витамина D используются различные маркеры, основные из которых – подавление избыточной секреции ПТГ, уровень абсорбции кальция, минеральная плотность костной ткани, снижение риска переломов. При анализе около 70 работ, посвященных исследованию взаимосвязи уровня ПТГ и 25(ОН)D, в большинстве из них уровни ПТГ начинали снижаться при повышении 25(OH)D до 15-20 нг/мл и максимально подавлялись при уровнях 25(ОН)D порядка 30-40 нг/мл [69]. По данным ряда исследований, адекватная абсорбция кальция в кишечнике у большинства людей происходит при уровнях 25(OH)D крови в диапазоне 12-20 нг/мл [2], однако имеются полученные независимыми группами данные в пользу порогового уровня для максимальной абсорбции кальция выше 30 нг/мл [70,71]. В работе Priemel M. и соавт. по результатам исследования костных биопсий было показано, что при уровнях 25(OH)D выше 30 нг/мл не регистрируются патологические дефекты минерализации костной ткани, а у 21% условно здоровых лиц с уровнями в диапазоне 20-30 нг/мл повышено содержание неминерализованного остеоида [57]. Данные наблюдательных и кросс- секционных исследований, рассмотренные в ряде мета-анализов, предполагают, что уровни 25(OH)D ниже 20 нг/мл повышают риск падения у пожилых и ассоциированы с большей частотой переломов [58–60]. В крупном РКИ, проведенном в Великобритании, при повышении уровня 25(OH)D крови от 21 до 29 нг/мл наблюдалось суммарное снижение основных остеопоротических переломов на 33% [61]. Мета-анализы Bischoff- Ferrari и соавт. показывают, что снижение частоты переломов при приеме препаратов витамина D не наблюдается при уровнях 25(OH)D ниже 30 нг/мл, а для некоторых переломов - ниже 40 нг/мл [46,62].
Открытие повсеместной экспрессии 1α-гидроксилазы в организме, возможности локального синтеза активной формы витамина D, а также колоссального количества генов, имеющих витамин D-чувствительный элемент (около 3% генома человека), повлекло за собой активное изучение неклассических эффектов витамина D, в частности, влияния на клеточный рост, нервно-мышечную проводимость, иммунитет и воспаление. Показана ассоциация низких уровней витамина D с различными заболеваниями человека, включая более высокий риск различных онкологических заболеваний, инфекций, аутоиммунных и сердечно-сосудистых заболеваний [54]. Полученные данные вызвали большой интерес в отношении возможного положительного эффекта при приеме добавок витамина D. К сожалению, проведенные в последние годы крупные РКИ, посвященные этому вопросу, не позволили ответить на него утвердительно [63–65], однако, нужно отметить, что включенные пациенты в большинстве своем не имели дефицита витамина D: средние исходные уровни в VIDA составили 24,2 нг/мл, VITAL - 30,8 нг/мл, D2d - 28,2 нг/мл. Таким образом, по мнению экспертов, доказательная база в отношении необходимости поддержания более высоких уровней 25(ОН)D, чем 30 нг/мл, в настоящее время недостаточна. Для оценки оптимальных пороговых значений 25(OH)D в отношении внекостных эффектов требуется проведение дополнительных исследований с включением пациентов с более низкими уровнями витамина D и более продолжительным периодом наблюдения.
Большинством экспертов и регуляторных органов в качестве безопасной верхней границы концентрации 25(ОН)D, позволяющей избежать развития гиперкальциемии – основного проявления токсичности витамина D, предлагается концентрация, равная 100 нг/мл (250 нмоль/л) [2,3,51]. При коррекции дефицита витамина D эксперты рекомендуют придерживаться более узкого диапазона целевых значений 25(ОН)D 30-60 нг/мл (75-150 нмоль/л), в связи с отсутствием доказательной базы по дополнительному положительному влиянию при более высокой концентрации 25(ОН)D, а также редкому превышению этих значений естественным путем у человека, даже в популяциях с круглогодичным воздействием естественного обилия солнечного света [66].
- При выявлении дефицита витамина D (25(OH)D <20 нг/мл) рекомендуется оценить уровни кальция, скорректированного на альбумин, фосфора, щелочной фосфатазы, ПТГ, креатинина (с расчетом СКФ), магния сыворотки крови [13– 15,17–22,72–80].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: При обнаружении сниженного уровня 25(OH)D целесообразен клинический и лабораторный скрининг состояний, для которых продемонстрирована ассоциация с дефицитом витамина D (Таб. 2) [13–15,17–22,72,73,80]. Данное обследование также позволяет получить более точную оценку кальций-фосфорного обмена и повысить эффективность назначаемого лечения. Так, низкие уровни магния могут быть ассоциированы с приемом таких достаточно часто назначаемых препаратов как ингибиторы протонной помпы [74]. Имеются данные о том, что уровень употребления магния может иметь обратную ассоциацию с риском дефицита и недостаточности витамина D [75]. В свою очередь, дефицит магния может приводить к снижению уровня 1,25(OH)2D и ПТГ, а также к развитию витамин D-резистентной гипокальциемии; описаны случаи магний-зависимого витамин D-резистентного рахита [76–78].
Корректировка кальция на уровень альбумина крови необходима с целью исключения ложно завышенных или ложно заниженных показателей кальциемии при изменении концентрации плазменных белков, особенно при уровне альбумина менее 40 г/л и более 45 г/л [79].
Формулы для расчета альбумин-скорректированного кальция:
- общий кальций плазмы (ммоль/л) = измеренный уровень общего кальция плазмы (ммоль/л) + 02 х (40 - измеренный уровень альбумина плазмы (г/л));
- общий кальций плазмы (мг/дл) = измеренный уровень общего кальция плазмы (мг/дл) +
0.8 х (4 - измеренный уровень альбумина плазмы (г/дл));
- коэффициент пересчёта: [кальций] мг/дл х 0,25 ==> [кальций] ммоль/л.
- Измерение уровня 1,25(ОН)2D в сыворотке крови не рекомендуется для оценки статуса витамина D, но может быть применено в качестве дополнительного метода исследования при некоторых заболеваниях, ассоциированных с врожденными и приобретенными нарушениями метаболизма витамина D и фосфора – в частности, при дифференциальной диагностике гипофосфатемического синдрома, при состояниях, сопровождающихся экстраренальной активностью фермента 1α- гидроксилазы (напр., при гранулематозных или лимфопролиферативных заболеваниях) [81,82].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: 1,25(ОН)2D циркулирует в крови в концентрациях до 1000 раз ниже, чем 25(ОН)D, и имеет время полужизни около 4 часов, жестко регулируется уровнями ПТГ, FGF23, кальция и фосфора крови и не отражает запасы витамина D в организме, поэтому не рекомендуется для определения статуса витамина D и его мониторинга. При дефиците витамина D и/или кальция в организме, сывороточные уровни 1,25(ОН)2D, как правило, в норме или даже выше референтных значений, что является следствием развития вторичного гиперпаратиреоза. Определение 1,25(ОН)2D может быть целесообразным при врожденных или приобретенных нарушениях метаболизма витамина D и фосфора, хронических гранулематозных заболеваниях и некоторых лимфомах, когда может иметь место дефицит или наоборот избыток активности фермента 1α- гидроксилазы [81,82].
- Измерение уровня 24,25(ОН)2D в сыворотке крови с расчетом соотношения 25(ОН)D к 24,25(ОН)2D рекомендуется при подозрении на дефицит активности фермента 24-гидроксилазы или токсичность витамина D, а также в качестве дополнительного параметра оценки статуса витамина D [83–89].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Не менее 20% случаев идиопатической гиперкальциемии остаются неразрешенными. Одной из возможных причин может являться дефицит активности 24-гидроксилазы, обусловленный генетическими вариантами CYP24A1 с потерей функции и клинически характеризующийся развитием гиперкальциемии, нефролитиаза и нефрокальциноза. Поскольку частота этого генетического дефекта пока недостаточно изучена, определение 24,25(ОН)2D и расчет соотношения 25(ОН)D к 24,25(ОН)2D могут быть использованы при подозрении на дефицит 24-гидроксилазы в качестве скринингового, более дешевого, чем генетическое исследование, метода. При этом состоянии сывороточные уровни 24,25(ОН)2D будут низкими, а соотношение 25(ОН)D к 24,25(ОН)2D – повышенным (в качестве порогового значения для данного соотношения рассматривается уровень, равный 80 и выше, однако, диагностические критерии требуют уточнения в крупных выборках) [83–87]. Аналогичная картина наблюдается при дефиците витамина D, который сопровождается физиологической инактивацией катаболического пути витамина D [85]. В связи с этим соотношение 25(ОН)D к 24,25(ОН)2D может быть рассмотрено в качестве дополнительного маркера достаточности витамина D в организме, этом параметр также продемонстрировал ассоциацию с клиническими исходами в пилотных исследованиях (в частности, с МПК и риском переломов) [88,89]. При гипервитаминозе витамина D, напротив, даже при высоких значениях 25(ОН)D соотношение 25(ОН)D к 24,25(ОН)2D сохраняется нормальным в силу пропорционального повышения продукции неактивного метаболита [87]. Таким образом, данное исследование является весьма информативным в дифференциальной диагностике гиперкальциемии, ассоциированной с витамином D.
2.4 Инструментальные диагностические исследования
-
Для определения спектра и тяжести костных нарушений пациентам с наличием клинических признаков рахита или остеомаляции рекомендуется рентгенологическая оценка структурных изменений скелета, включая обзорную рентгенографию тазовых костей, рентгенографию длинных трубчатых костей [90– 93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 4)
Комментарии: Основные рентгенологические проявления алиментарного рахита и остеомаляции заметны при рутинном рентгенографическом исследовании: общее снижение видимой плотности кости, деформации позвонков (двояковогнутая деформация, или деформация по типу «рыбьих позвонков») и псевдопереломы (или зоны Лоозера). Самым ранним рентгенологическим проявлением ПТГ-опосредованной резорбции кости является общее истончение кортикального слоя длинных костей. Более поздние изменения включают поднадкостничную резорбцию кости (лучше всего видна на радиальной стороне средних фаланг, пястных костей и плюсневых костей) и «бурые» опухоли (фиброзно-кистозный остеит) и наблюдаются в более запущенных случаях тяжелого гиперпаратиреоза [90,91]. Хотя последние костные аномалии могут исчезнуть после терапии витамином D, истончение кортикального слоя сохраняется вместе с увеличенным риском перелома; псевдопереломы могут также прогрессировать до полного перелома [92,93].
2.5 Иные диагностические исследования
Не применяются.
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
3.1 Медикаментозное лечение
- Для лечения дефицита и недостаточности витамина D рекомендуется
использование колекальциферола** (D3) [94–96].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1) Комментарии: При лечении дефицита/недостаточности витамина D, предпочтение отдается форме D3 (колекальциферол**), которая обладает сравнительно большей эффективностью в достижении и сохранении целевых значений 25(OH)D в сыворотке крови [94–96]. Зарегистрированные в РФ препараты колекальциферола** приведены в таблице 4.
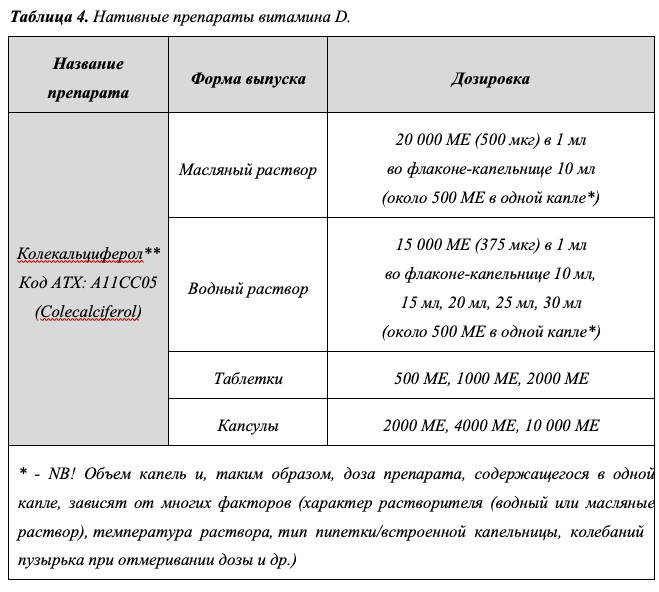
-
- Лечение дефицита витамина D (уровень 25(ОН)D в сыворотке крови <20 нг/мл) у взрослых рекомендуется начинать с суммарной насыщающей дозы колекальциферола** 400 000 МЕ с использованием одной из предлагаемых схем, с дальнейшим переходом на поддерживающие дозы (Таб. 5). Выбор схемы (ежедневный, еженедельный, ежемесячный прием) определяется индивидуально с учетом предпочтений пациента и максимальной ожидаемой приверженности к лечению [64,97–106].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
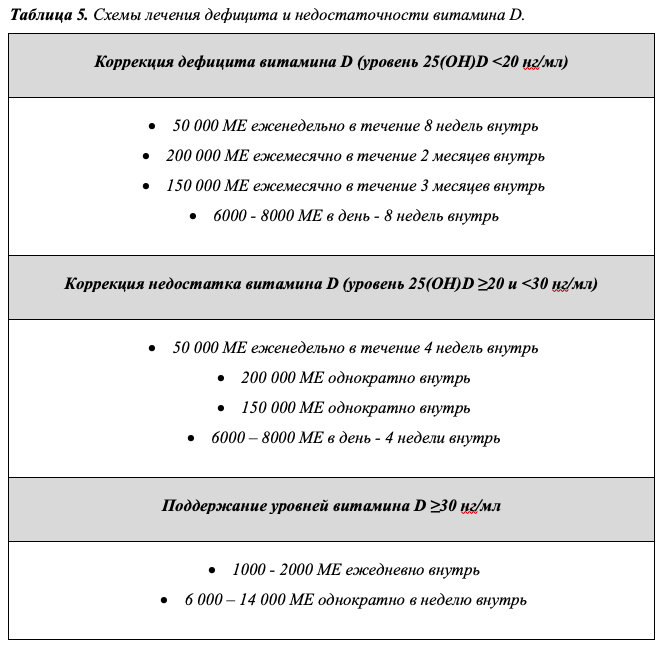
Комментарии: В отношении коррекции дефицита витамина D у взрослых продемонстрирована эффективность и безопасность начальной болюсной дозы витамина D, а также еженедельного перорального приема 50 000 МЕ витамина D в
течение 8 недель [97,99]. Поскольку эффективность достижения целевого уровня 25(OH)D не изменяется при различном режиме приема витамина D (ежедневный, еженедельный или ежемесячный) [100,101], альтернативным подходом может являться ежедневный прием эквивалентной дозы витамина D (6 000 – 8 000 МЕ в течение 8 недель), что подтверждено результатами отечественных исследований [102]. Для достижения максимальной приверженности лечению при выборе схемы следует учитывать индивидуальные особенности и пожелания пациента.
Продолжительность поддерживающей терапии и эффективная поддерживающая терапия для взрослых с целевым достигнутым или исходным уровнем витамина D четко не определены. Прием 50 000 МЕ витамина D каждые 2 недели (что эквивалентно 3500 МЕ в сутки) показал эффективность в поддержании уровня 25(OH)D в целевом диапазоне выше 30 нг/мл и отсутствие значимых побочных эффектов при наблюдении до
6 лет [103,104]. Суточной дозы в 2000 МЕ, по данным ряда исследований, может оказаться недостаточно для достижения таких показателей [105,106], но в некоторых исследованиях оказались эффективными и более низкие дозы (900 – 1800 МЕ в сутки) [98], что подтверждается опытом отечественных экспертов. Важно отметить, что в исследовании VITAL при пятилетнем наблюдении пациентов, получавших 2000 МЕ витамина D ежедневно, не было отмечено проблем с безопасностью в отношении гиперкальциемии, камней в почках или почечной недостаточности [64]. По данным отечественных исследований, при приеме 10 000 МЕ колекальциферола** в неделю уровни выше 30 нг/мл сохраняются у 70% пациентов, а при приеме 2000 МЕ в сутки – у 50% [102]. В связи с отсутствием данных, свидетельствующих о необходимости приема более высоких доз, эксперты не рекомендуют назначение суточных доз выше 2000 МЕ в общей популяции при отсутствии значимых факторов риска дефицита витамина D.
• Коррекция недостаточности витамина D (уровень 25(ОН)D в сыворотке крови ≥20 и <30 нг/мл) рекомендуется с использованием половинной суммарной насыщающей дозы колекальциферола**, равной 200 000 МЕ, с дальнейшим переходом на поддерживающие дозы (Таб. 5) [97,106].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Изменение концентрации 25(OH)D в сыворотке крови при любой используемой дозе достаточно индивидуально и, по данным клинических исследований, зависит от исходного уровня - чем ниже исходный уровень, тем больше прирост [97]. Вместе с тем, фармакокинетические исследования, характеризующие «доза-эффект»,
указывают на то, что скорость повышения концентрации 25(OH)D является линейной и составляет примерно 0,4 нг/мл/мкг/сутки, то есть, прием каждых дополнительных 100 МЕ витамина D в сутки увеличивает уровень 25(OH)D в сыворотке менее чем на 1 нг/мл [106]. В связи с этим, для коррекции недостаточности витамина D (уровень 25(ОН)D 20- 29 нг/мл) рекомендуется использовать насыщающие дозы с дальнейшим переходом на поддерживающую терапию c применением половины суммарной насыщающей дозы, применяемой для коррекции дефицита витамина D (Таб. 5).
• Пациентам с ожирением, синдромами мальабсорбции, а также принимающим препараты, нарушающие метаболизм витамина D, рекомендуется прием более высоких (в 2-3 раза) насыщающих доз колекальциферола** для лечения дефицита витамина D (800 000 – 1 200 000 МЕ) и недостаточности витамина D (400 000 – 600 000 МЕ) с переходом на поддерживающую дозу не менее 3000 – 6000 МЕ в сутки [107–116].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: В мета-анализах РКИ продемонстрировано, что ожирение снижает эффективность терапии колекальциферолом**, уменьшая прирост уровня 25(ОН)D примерно на 15 нг/мл [107]. Исследования «доза-эффект» также подтверждают сниженный ответ на терапию колекальциферолом** при ожирении [108,109] и свидетельствуют о том, что повышение 25(OH)D при приеме колекальциферола** напрямую зависит от дозы и массы тела: на каждую единицу прироста 25(OH)D (1 нг/мл) требуется около 2,5 МЕ/кг [108]. При этом, болюсная доза может быть менее эффективна, чем еженедельный прием [110]. У пациентов с синдромом мальабсорбции сохраняется высокий риск дефицита витамина D, несмотря на получаемое лечение [111]. Сходная ситуация отмечается у пациентов, получающих лекарственную терапию, влияющую на метаболизм витамина D (в частности, противоэпилептические препараты) [112,113]. Этим пациентам требуются более высокие дозы для поддержания адекватных уровней 25(OH)D [114–116].
• У пациентов с ХБП рекомендуется коррекция дефицита и недостаточности витамина D с использованием стандартных для общей популяции режимов [117– 125].
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 2)
Комментарии: Согласно данным мета-анализов обсервационных исследований среднего и высокого качества, у пациентов с ХБП более высокие уровни 25(OH)D ассоциированы со значимым снижением смертности от всех причин и снижением сердечно-сосудистой смертности у диализных пациентов – 14-22% на каждые 10 нг/мл увеличения уровня 25(ОН)D [117–119]. При этом, снижение риска у диализных пациентов было непрерывным в диапазоне уровней 25(OH)D от 5 до 40 нг/мл, а у предиализных пациентов максимальное снижение риска достигалось при уровнях 25(OH)D равных 25-30 нг/мл [119]. Оптимальные уровни 25(ОН)D у предиализных пациентов достигались при использовании суточных доз колекальциферола** более 2000 МЕ в большинстве клинических исследований [120], при этом терапия не сопровождалась значимым изменением сывороточных уровней кальция и фосфора, эпизоды гиперкальциемии и гиперфосфатемии были редкими (2-3% и 0,8-7% соответственно) и разрешались при коррекции терапии [121]. Терапия колекальциферолом** у диализных пациентов способствовала поддержанию более высоких уровней 25(ОН)D, но позволила достигнуть рекомендованных уровней только у 57% пациентов, при этом используемые дозы колекальциферола** широко варьировали (от 6000 до 200 000 МЕ в неделю). Данная терапия не сопровождалась развитием гиперкальциемии, но приводила к значимому увеличению сывороточного фосфора [122]. Сердечно-сосудистые эффекты терапии колекальциферолом** при ХБП не изучались прицельно в РКИ, а ретроспективный анализ существующих РКИ не продемонстрировал доказательств того, что прием колекальциферола** влияет на смертность пациентов с ХБП [123], но в ретроспективном обсервационном исследовании лечение дефицита витамина D у предиализных пациентов было ассоциировано со значительным снижением частоты сердечно-сосудистых событий [124]. Таким образом, в настоящее время специфический протокол восполнения дефицита и недостаточности витамина D не разработан, при этом клинические рекомендации Kidney Disease Improvement Global Outcomes (KDIGO) 2017 г. предполагают коррекцию с использованием стратегии, принятой для общей популяции [125], что соотносится с позицией отечественных экспертов.
• Для лечения и профилактики аутоиммунных заболеваний не рекомендуется использование колекальциферола**. У пациентов с аутоиммунными заболеваниями рекомендуется коррекция дефицита и недостаточности витамина D с использованием стандартных для общей популяции режимов [126–153] .
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: В мета-анализах продемонстрирована ассоциация низких уровней 25(ОН)D с рядом аутоиммунных заболеваний, в частности, с сахарным диабетом 1 типа [126,127,138,147], системной красной волчанкой [148–150], заболеваниями щитовидной железы [151–153], витилиго [128], несколько менее убедительная ассоциация продемонстрирована для рассеянного склероза [129,130], ревматоидного артрита [131– 133], синдрома Шегрена [134,135]. Также показаны положительные эффекты приема витамина D на некоторые параметры течения основного заболевания – для сахарного диабета 1 типа [136], рассеянного склероза [137,139], системной красной волчанки [140], аутоиммунного тиреоидита [141]. В систематическом обзоре Cochrane 2018 г. и более позднем мета-анализе не получено убедительных подтверждений улучшения течения рассеянного склероза при приеме витамина D [142,143], мета-анализ 2019 г. также не продемонстрировал значимых эффектов витамина D на течение системной красной волчанки [144]. Post-hoc анализ исследования VITAL продемонстрировал снижение заболеваемости аутоиммунными заболеваниями на 25-30% в группе приема витамина D [154], однако специально запланированные интервенционные исследования для оценки влияния витамина D на риск развития аутоиммунных заболеваний не проводились. Таким образом, на момент составления настоящих рекомендаций эксперты согласны с заключением Европейского общества клинических и экономических аспектов остеопороза и остеоартрита (ESCEO) и мета-анализом 2017 г. об отсутствии достаточной доказательной базы для использования препаратов витамина D с целью профилактики и лечения внескелетных хронических заболеваний, а также с необходимостью дальнейшего подтверждения результатов, полученных в отношении аутоиммунных заболеваний (включая сахарный диабет 1 типа, рассеянный склероз и системную красную волчанку), сердечно-сосудистых заболеваний и общего снижения смертности, в РКИ достаточной мощности с длительным периодом наблюдения и клинически значимыми конечными точками [145,146].
• У беременных рекомендуется коррекция дефицита и недостаточности витамина D с использованием доз не выше 4000 МЕ в сутки в первом триместре, на более поздних сроках - стандартными для общей популяции схемами [155–160].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: Проведены лишь единичные исследования с участием беременных женщин, в которых оценивалась безопасность добавок витамина D (4000 МЕ в сутки или 200 000 МЕ однократно), при этом не сообщалось о побочных эффектах данных доз
[155,156]. В ряде других работ, оценивавших влияние высоких доз колекальциферола** на исходы беременности, также не зарегистрировано побочных эффектов, связанных с токсичностью витамина D [157–159]. Результаты систематического обзора Cochrane свидетельствуют о том, что прием беременными женщинами доз витамина D в диапазоне выше общепринятых профилактических (от 600 до 4000 МЕ в сутки) может снизить риск гестационного диабета, однако не оказывает значимого влияния на риск преэклампсии, преждевременных родов и низкой массы тела при рождении, тогда как прием беременными женщинами витамина D в количестве, превышающем текущий верхний предел (4000 МЕ в сутки и выше), по-видимому, не оказывает значимого влияния на оцениваемые исходы [160]. При этом, срок начала приема препаратов значительно варьировал между исследованиями, и лишь в нескольких исследованиях прием был начат на очень ранних сроках беременности, в то время как в большинстве исследований препараты были добавлены во втором триместре, в нескольких исследованиях – начиная с третьего триместра. В связи с этим, с учетом ограниченного количества данных о безопасности применения высоких доз колекальциферола** в первом триместре беременности, не рекомендуется использование доз, превышающих 4000 МЕ в сутки, у таких пациентов.
• Рутинное динамическое исследование концентрации 25(ОН)D при приеме колекальциферола** не рекомендуется. Повторная оценка уровня витамина D рекомендуется через 8-12 недель у пациентов с исходным тяжелым дефицитом витамина D или сохраняющимся риском тяжелого дефицита (например, синдром мальабсорбции, метаболические заболевания костей, морбидное ожирение, прием лекарственных средств), у остальных пациентов – не ранее чем через 6 месяцев лечения [161–163].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 3)
Комментарии: Фармакокинетика витамина D достаточно сложна, и эффективность лечения ассоциирована со множеством факторов [161]. При построении регрессионной модели основным предиктором уровня 25(OH)D после лечения являлся ИМТ, который объяснял 21,6% вариабельности концентрации 25(OH)D [162]. У подавляющего большинства пациентов с синдромом мальабсорбции может наблюдаться сниженное всасывание стандартной дозы колекальциферола** [163]. Таким образом, мониторинг концентрации 25(OH)D во время приема препаратов витамина D не требуется большинству пациентов, но целесообразен у пациентов с исходным тяжелым дефицитом
витамина D, нарушениями всасывания или метаболизма витамина D, а также при подозрении на плохое соблюдение режима приема препарата. У пациентов с риском стойкого снижения уровня 25(OH)D оправданно проведение повторного тестирования через 8–12 недель для определения дальнейшей тактики ведения. У остальных пациентов повторное тестирование следует проводить не ранее чем 6 месяцев приема добавок витамина D.
• При неэффективности стандартных схем лечения дефицита витамина D рекомендуется обследование, направленное на исключение вторичных причин дефицита витамина D (Таб. 2).
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 5)
Комментарии: Если стандартные схемы лечения дефицита витамина D оказались неэффективными, до наращивания доз препаратов витамина D целесообразно проведение дополнительного обследования для выявления факторов риска дефицита витамина D, которые отражены в таблице 2. Объем необходимого обследования определяется индивидуально в соответствии с клиническим контекстом.
• Всем лицам рекомендуется адекватное возрасту потребление кальция с пищей. При недостаточном потреблении кальция с продуктами питания рекомендуется применение добавок кальция для обеспечения суточной потребности в этом элементе [2,51,164–174].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии: Кальций является строительным материалом для костной ткани, основным участником кальций-фосфорного обмена. Действие витамина D в основном направлено на оптимизацию гомеостаза кальция в организме, в том числе, для целей минерализации костного матрикса, но возможности его не безграничны и в условиях критического дефицита кальция проявления дефицита витамина D в виде рахита/остеомаляции резко возрастают. Предполагается, что ключевым патофизиологическим следствием низкого потребления кальция является повышение образования 1,25(ОН)2D [51]. Имеются доказательства того, что ответ на терапию остеопороза может быть более выражен, если обеспечивается достаточное употребление витамина D и кальция [167,168].
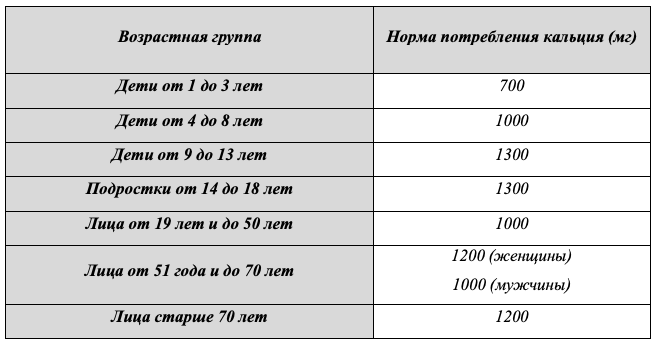
Таким образом, адекватное поступление кальция необходимо для максимальной реализации функций витамина D. Кальций содержится во многих продуктах питания, поэтому следует стремиться к максимальному обеспечению суточной потребности в кальции путем достаточного употребления его с пищей. Рекомендуемая суточная доза потребления кальция варьирует в зависимости от возраста, пола и отдельных физиологических или патологических состояний, составляя для взрослых, как правило, от 1000 до 1300 мг (Таб. 6). Это рекомендованное потребление, однако, не всегда достигается диетой. Основные причины недостаточного содержания кальция в рационе и его усваивания - это наличие в пище фитатов (содержатся в семенах злаковых, бобовых, масличных культур) и оксалатов (содержатся в щавеле и ревене, киноа, чайных листьях), которые связывают содержащийся в этих продуктах кальций и препятствуют его всасыванию [169,170], увеличение потребления бутилированной воды с низким содержанием минеральных веществ, снижение потребления молочных продуктов с целью контроля уровня холестерина [171] либо в связи с непереносимостью лактозы [172] и, особенно в детстве, рост распространенности аллергии на коровье молоко [173].
Таблица 6. Возрастные нормы потребления кальция [2].
Молочные продукты являются основным источником биодоступного кальция и лишь некоторые другие продукты содержат столько же кальция (например, кунжут, амарант, лесной орех, миндаль), которые вряд ли можно употреблять в той же пропорции, что и молоко [2]. Чтобы восполнить суточную потребность в кальции, взрослому человеку необходимо потреблять не менее трёх порций молочных продуктов в день. К примеру, одной порцией считается 150 г творога, 200 мл молока или кисломолочных продуктов (кефир, ряженка, айран и др.), 150 г йогурта или 30 г твердого сыра [174]. Для людей, не получающих достаточное количество кальция с пищей, рекомендуется дополнительный прием препаратов в дозах, необходимых для обеспечения суточной нормы потребления, однако предпочтительным источником являются продукты питания. По данным крупных мета-анализов, оценивавших взаимосвязь потребляемого кальция со смертностью от различных причин, большее употребление кальция с пищей ассоциировано со снижением смертности от всех причин, тогда как данные об ассоциации общего потребления кальция и потребления кальция из добавок со смертностью оказались дискордантными в этих работах [164,165]. В частности, при суб-анализе исследований с периодом наблюдения более 10 лет продемонстрировано значимое повышение смертности от сердечно-сосудистых заболеваний при более высоком общем потреблении кальция, тогда как в другой работе продемонстрирована обратная взаимосвязь; потребление кальция из добавок было ассоциировано со смертностью только в одном из мета-анализов. В настоящее время не доказаны преимущества приема кальция в виде какой-либо конкретной его соли, однако для корректного усваивания препарата может иметь значение соблюдение режима приема (в частности, карбонат кальция должен приниматься во время или после еды, поскольку для адекватного всасывания необходима кислая среда желудка, тогда как цитрат кальция не требует этого) [166].
- Рутинное назначение препаратов витамина К при лечении дефицита и недостаточности витамина D не рекомендуется [175,176].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 1)
Комментарии: Данные экспериментальных работ свидетельствуют о том, что витамин D и витамин К могут обладать синергией в отношении поддержания здоровья костной ткани, преимущественно за счет влияния на синтез остеокальцина. Кроме того, предполагается, что витамин К может оказывать положительное влияние на процесс кальцификации сосудистой стенки, наблюдаемый у пациентов с терминальной стадией ХБП, ассоциированной с недостаточностью витамина К (в настоящее время продолжаются клинические исследования, оценивающие влияние приема препаратов витамина К у пациентов с ХБП, получающих лечение гемодиализом) [175]. Мета-анализ РКИ, посвященный влиянию комбинированного приема витамина D и витамина К на состояние скелета в общей популяции, продемонстрировал некоторые преимущества такого назначения (увеличение общей МПК, снижение уровня недодекарбоксилированного остеокальцина), однако не позволяет сделать однозначных выводов о его пользе [176]. В связи с этим, требуется проведение дополнительных исследований для оценки эффекта от комбинированного воздействия этих витаминов на здоровье костей, особенно в популяциях с более высоким риском дефицита витамина К (например, пациенты с ХБП), с более четким формулированием конечных точек (в частности, оценка риска переломов).
- Для исключения гиперкальциемии рекомендовано исследование уровня кальция крови, скорректированного на альбумин, в следующих ситуациях: после лечения дефицита и недостаточности витамина D, при уровнях 25(ОН)D выше 60 нг/мл, перед назначением препаратов витамина D при гранулематозных заболеваниях, при подозрении на дефицит 24-гидроксилазы. При выявлении гиперкальциемии рекомендовано также исследование уровня ПТГ [2,3,50,177–182].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 3)
Комментарии: Несмотря на то, что токсичность витамина D является достаточно редким явлением в абсолютных значениях, в последние годы повсеместно наблюдается явный тренд по увеличению частоты регистрируемых случаев [177]. По оценкам, проведенным в США, в сравнении с 2000 г. ежегодно стало регистрироваться в 17 раз больше случаев [178].
Причинами витамин D-опосредованной гиперкальциемии может является избыточное употребление препаратов витамина D (в частности, бесконтрольный прием больших доз биологически активных добавок в течение длительного времени), эктопическая продукция активного метаболита витамина D (1,25-дигидроксивитамина D) или снижение активности 24-гидроксилазы в связи с наличием инактивирующей мутации CYP24A1. Основными лабораторными находками при интоксикации витамином D, обусловливающими клиническую симптоматику, является гиперкальциемия и гиперкальциурия, также отмечается гиперфосфатемия и супрессия уровня ПТГ. Несмотря на то, что точный отрезной порог для концентрации 25(ОН)D, сопровождающейся риском токсичности, неизвестен, эксперты склоняются к тому, что концентрации 25(OH)D выше 80 нг/мл в сочетании с гиперкальциемией и анамнезом приема высоких доз витамина D следует рассматривать как интоксикацию витамином D [179].
Около 3% взрослых в США регулярно принимают добавки витамина D в дозе выше 4000 МЕ в сутки [180], которая общепризнанно считается максимальным уровнем регулярного суточного потребления, не сопровождающимся нежелательными эффектами [2,3,50]. Вместе с тем, повышение уровня кальция может иметь место даже при приеме умеренных доз колекальциферола**: среди пациентов с дефицитом витамина D, которые принимали 800-2000 МЕ колекальциферола** в сутки в течение 1 года, эпизоды гиперкальциемии наблюдалась у 9% [181]. При назначении препаратов колекальциферола** следует также помнить, что нарушения метаболизма витамина D (в частности, инактивирующие мутации фермента 24-гидроксилазы или эктопическая активность 1α-гидроксилазы при гранулематозных заболеваниях) могут изменять потребность в витамине D и приводить не только к избыточной продукции активной формы витамина D и гиперкальциемии, но и к развитию нефрокальциноза [182]. Кроме того, после восполнения дефицита витамина D может проявиться гиперкальциемия вследствие первичного гиперпаратиреоза, которая до лечения была замаскирована дефицитом витамина D. Таким образом, хотя витамин D-опосредованная гиперкальциемия является относительно редкой по сравнению с первичным гиперпаратиреозом и онкогенной гиперкальциемией, истинная распространенность её неизвестна, и вероятно, может увеличиваться с увеличением потребления витамина D среди населения в целом и появлением новой информации о распространенности мутаций CYP24A1. В связи с этим, целесообразен скрининг гиперкальциемии после завершения приема колекальциферола** в лечебной дозе, у пациентов с супрафизиологическими концентрациями витамина D и при назначении витамина D пациентам с известным или предполагаемым нарушением метаболизма витамина D.
- Рутинное назначение активных метаболитов витамина D (альфакальцидол**, кальцитриол**) не рекомендуется для лечения дефицита витамина D, однако их применение рекомендуется при наличии показаний у пациентов с установленным нарушением метаболизма витамина D, в том числе в комбинированной терапии с препаратами нативного витамина D [183,184].
Уровень убедительности рекомендаций A (уровень достоверности доказательств – 1)
Комментарии: Альфакальцидол нуждается только в одном гидроксилировании в печени посредством 25-гидроксилазы для превращения в D-гормон, в связи с чем он остаётся эффективным у пациентов с терминальной стадией ХБП, сопровождающейся снижением активности 1α-гидроксилазы. Кальцитриол эффективен даже при тяжелых поражениях печени, поскольку не нуждается в дополнительных этапах метаболизма для обретения биологической активности. Активные метаболиты витамина D и их аналоги не определяются в значимых количествах при исследовании концентрации витамина D в сыворотке крови, в связи с чем на фоне приема этих препаратов необходимо контролировать содержание кальция в сыворотке крови и моче, а также проводить коррекцию дозы препарата в случае гиперкальциемии/гиперкальциурии.
Таким образом, ввиду значительно более высокой стоимости и необходимости мониторирования кальциемии и кальциурии не рекомендуется использование активных метаболитов витамина D в тех случаях, когда возможно эффективное применение нативного витамина D [183]. Назначение активных метаболитов витамина D и их аналогов рекомендуется у пациентов с установленным нарушением метаболизма витамина D по абсолютным и относительным показаниям [184], приведенным в Таблице
- Вместе с тем, при установленном снижении концентрации 25(OH)D его коррекция нативным витамином D является обязательным этапом лечения и должна проводиться, в том числе, пациентам с терминальной стадией почечной недостаточности и наследственными нарушениями метаболизма витамина
Таблица 7. Показания к назначению активных метаболитов витамина D

3.2 Иное лечение
Не применяется.
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов медицинской реабилитации, в том числе основанных на использовании природных лечебных факторов
В настоящее время нет убедительных научных доказательств эффективности санаторно-курортного лечения как метода стойкого безопасного поддержания оптимальных уровней витамина D.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
• Рекомендуемыми препаратами для профилактики дефицита витамина D являются колекальциферол** (D3) и эргокальциферол (D2) [185–187].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
Комментарии: Витамин D3 и D2 часто называют «нативными», при этом витамин D3 синтезируется в коже человека и поступает из животных продуктов питания, а D2 поступает из продуктов растительного происхождения, в связи с чем может быть предпочтителен у приверженцев веганского питания [185]. Обе формы не обладают исходной активностью и способны накапливаться в жировой ткани, создавая депо, с чем и связана их низкая токсичность, широкий терапевтический диапазон и возможность применения в высоких дозах. При этом D3 показал сравнительно большую эффективность в отношении поддержания стабильной концентрации 25(ОН)D при длительном приеме [186,187]. Нативный витамин D может применяться с едой или натощак, не требует дополнительного содержания в пище жиров для абсорбции.
• Взрослым лицам для профилактики дефицита витамина D рекомендуется
поступление 800 - 1000 МЕ витамина D в сутки [2,3,188–200].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 1)
Комментарии: В 2010 г. Институт медицины США признал общепринятую до этого норму суточного потребления витамина D 200 МЕ недостаточной и рекомендовал новые нормы, составляющие 400 МЕ в сутки для младенцев, 600 МЕ в сутки для детей, подростков и взрослых и 800 МЕ в сутки для взрослых старше 70 лет [2]. Эти пороговые значения одобрены большинством клинических рекомендаций, поскольку позволяют
достичь уровней 25(OH)D более 20 нг/мл у 97% индивидуумов, обеспечивающих оптимальное состояние костно-мышечной системы [3,193,194]. Однако, более поздние исследования, основанные на анализе данных отдельных участников РКИ, свидетельствуют о том, что необходимое для достижения этих целей потребление витамина D выше и составляет около 1000 МЕ в сутки [195].
За последние годы было выполнено четыре мета-анализа, посвященных оценке пользы витамина D для профилактики переломов [196–199]. Только в одном из них обнаружено значимое снижение общего числа переломов на 15% (ОР = 0,85; 95% ДИ 0,73–0,98) и переломов бедра на 30% (ОР = 0,70; 95% ДИ 0,56–0,87) для ежедневного приема витамина D и кальция [197]. Три других мета-анализа не продемонстрировали пользу витамина D, однако, чтобы передать эти результаты в клиническую практику, важно понимать цели и целевые группы этих работ. В мета-анализах Zhao и соавт. [196] и Рабочей группы США по профилактике (USPTF) [199] обеими группами авторов отмечено, что результаты применимы только к взрослым людям без установленного остеопороза, дефицита витамина D или высокого риска падений. Таким образом, результаты не применимы к большому сегменту пожилых людей, у которых есть эти факторы риска. Четвертый мета-анализ Bolland и соавт. [198] включил работы по первичной и вторичной профилактике среди взрослых в возрасте 50 лет и старше, однако, при этом не включались работы, изучающие комбинированный прием кальция и витамина D (примерно 40% высококачественных исследований). Фактически, ре-анализ с включением исследований дозы витамина D 800–1000 МЕ при соблюдении приверженности к лечению более 50%, а также исключением исследований ежегодного приема высоких доз, значимое снижение общего числа переломов на 14% (ОР = 0,86; 95% ДИ 0,75–0,98) и падений на 12% (RR = 0,88; 95% CI 0,81–0,95) [200]. Суб-анализы РКИ
указывают на то, что нецелевой прием витамина D пожилыми людьми может не нести клинически значимой пользы для МПК, тогда как при исходном выраженном дефиците витамина D (менее 12 нг/мл) наблюдается существенное улучшение костной плотности [188,189]. Ежегодный прием высоких доз витамина D (300 000 - 500 000 МЕ) показал неэффективность в отношении профилактики падений и переломов и даже потенциальное увеличение риска, в связи с чем не рекомендуется для профилактики дефицита витамина D [190,191].
Что касается влияния приема витамина D на другие органы и системы, крупный систематический обзор US Preventive Task Force, включивший проведенные в последние годы крупные РКИ (в частности, Vitamin D Assessment (VIDA), Vitamin D and Omega-3
(VITAL), и Vitamin D and Type 2 Diabetes (D2d)), сделал вывод об отсутствии значимой пользы для здоровья от дополнительного приема витамина D у лиц без имеющегося его дефицита или с бессимптомным дефицитом [192]. Однако, нет оснований утверждать по результатам этих исследований, что витамин D не влияет на риск развития рака, на сердечно-сосудистую систему или развитие сахарного диабета. Для ответа на этот вопрос требуется проведение дополнительных исследований, включающих группы с более низкими исходными уровнями витамина D. Кроме того, для таких конечных точек, как рак и сердечно-сосудистые заболевания, необходимо проводить исследования с длительным периодом наблюдения (более 5 лет). Нужно отметить, что, по мнению экспертов, выбор тактики в отношении дополнительного приема витамина D с точки зрения повседневной практики зависит от ряда факторов, как клинических, так и окружающей среды, в связи с чем затруднено транслирование рекомендаций между отдельными популяциями [3,194].
• Беременным и кормящим женщинам для профилактики дефицита витамина D
рекомендуется получать 800 – 2000 МЕ витамина D в сутки [2,155,160,201–204].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Дефицит витамина D очень широко распространен среди беременных кормящих женщин во всем мире, несмотря на действующие рекомендации по его профилактике [201]. Согласно результатам систематического обзора Cochrane, данные
22 исследований с участием 3725 беременных женщин предполагают, что прием витамина D во время беременности может обладать некоторыми положительными эффектами в отношении исходов беременности (снижать риск преэклампсии, гестационного диабета и риск рождения ребенка с низким весом при рождении, но не влияет значимо на риск преждевременных родов), а прием витамина D с кальцием может снижать риск преэклампсии, но при этом повышать риск преждевременных родов [202]. При этом, указанные эффекты отмечались преимущественно при более высоких дозах, чем 600 МЕ в сутки, что было ранее рекомендовано Институтом медицины и Обществом акушеров-гинекологов США [2,160,203]. Возможность назначения больших профилактических доз витамина D продемонстрирована в рандомизированных контролируемых исследованиях [155,204]. В частности, в крупном РКИ Hollis и соавт., включившем почти 500 беременных женщин, получавших 400, 2000 или 4000 МЕ витамина D в день, достоверных различий в безопасности приема витамина D в группах не отмечено [155].
• На длительный период (более 6 месяцев) без лабораторного контроля не рекомендуется назначение доз витамина D более 4000 МЕ в сутки лицам без факторов риска дефицита витамина D и 10 000 МЕ в сутки - лицам, имеющим факторы риска [2,3,51,84,205–208].
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Большинство экспертов считают, что развитие токсических проявлений витамина D является очень редким явлением и связано преимущественно с непреднамеренным приемом внутрь очень высоких доз витамина, в сотни и тысячи раз превышающих максимально допустимые в течение продолжительного периода времени [205].
Все же некоторые группы пациентов могут быть более чувствительны к приему витамина D. Это, прежде всего, пациенты с гранулематозными заболеваниями, включающими саркоидоз, туберкулез, хронические грибковые инфекции, некоторые лимфомы с активированными макрофагами, нерегулируемо продуцирующими 1,25(ОН)2D [206], а также пациенты с дефицитом 24-гидроксилазы, у которых нарушается инактивация метаболитов витамина D [84]. У таких пациентов назначение препаратов витамина D должно проводиться с осторожностью, под контролем показателей кальций-фосфорного обмена крови, ввиду повышенного риска гиперкальциемии и гиперкальциурии, которые чаще наблюдаются у таких пациентов при уровнях 25(OH)D более 30 нг/мл.
На сегодняшний день регуляторным органам трудно рекомендовать конкретный уровень максимальной безопасной дозы для профилактического приема, но большинство из них остановились на 4000 МЕ в сутки в качестве безопасного верхнего уровня потребления витамина D [2,51]. Однако, для пациентов, имеющих факторы риска дефицита витамина D (в особенности, синдром мальабсорбции или ожирение) и соответственно большую потребность в витамине D, граница токсичности также может быть выше, что признается рядом экспертов [3,207]. По результатам трехлетнего наблюдения в РКИ, профиль безопасности витамина D оказался аналогичен для суточных доз 400, 4000 и 10 000 МЕ [208]. Гиперкальциемия встречалась редко в абсолютных значениях (отмечена у 15 участников, что соответствовало 4%), при этом чаще встречалась у получающих более высокие дозы, была умеренной (кальций общий в диапазоне 2,56-2,64 ммоль/л) и транзиторной во всех случаях. Гиперкальциурия встречалась достаточно часто (отмечена у 23% участников) и чаще возникала при
приеме более высоких доз (17%, 22% и 31% соответственно, р=0.011), однако не являлась причиной прекращения участия в исследовании.
Таким образом, для взрослого населения при невозможности лабораторного контроля уровня 25(OH)D и кальция во время длительного (более 6 месяцев) лечения рекомендуется придерживаться доз не выше 4 000 МЕ в сутки для лиц без факторов риска недостаточности витамина D и не более 10 000 МЕ в сутки для лиц с риском дефицита витамина D. Подобное ограничение не касается случаев подтвержденного дефицита/недостаточности витамина D, для лечения которых может потребоваться прием более высоких доз для достижения целевого значения уровня 25(ОН)D в крови.
6. Организация оказания медицинской помощи
Оказание медицинской помощи пациентам с дефицитом и недостаточностью дефицита витамина D осуществляется в амбулаторном порядке. Некоторым пациентам может быть показана госпитализация в стационар по поводу фонового заболевания (см. раздел «Этиология и патогенез»).
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
Критерии оценки качества медицинской помощи:
- Выполнена оценка наличия факторов риска дефицита витамина D
- Исследована концентрация 25(ОН)D в сыворотке крови у лиц с факторами риска дефицита витамина D
- Назначено патогенетическое лечение всем лицам с установленным диагнозом дефицит и недостаточность витамина D
Источник: Общественная организация «Российская ассоциация эндокринологов»
